Cholesterin wichtig für die Signalübertragung in Zellen
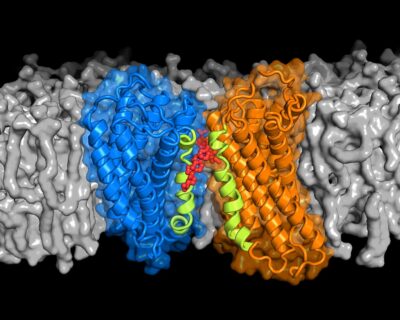
Computersimulation ermöglichen Einblicke in die Funktion von Proteinen.
Cholesterin kann wichtige Proteine so zu Paaren binden, dass humane Zellen auf äußere Signale reagieren. Wissenschaftler der FAU haben diese Vorgänge mittels Computersimulationen tiefergehend untersucht. Das Forschungsjournal PLOS Computational Biology* hat die Ergebnisse der Wissenschaftler vom Lehrstuhl für Biotechnik nun in der aktuellen Ausgabe veröffentlicht.
Die FAU-Nachwuchswissenschaftler Kristyna Pluhackova und Stefan Gahbauer haben herausgefunden, dass Cholesterin auf die Funktion der Signalübertragung im Körper starken Einfluss nimmt. Das Hauptaugenmerk der Untersuchung lag dabei auf dem Chemokinrezeptor CXCR4, der zu der Gruppe sogenannter G-Protein-gekoppelter Rezeptoren (GPCR) gehört. Diese nehmen verschiedene äußere Reize wahr, zum Beispiel Licht, Hormone oder Zucker, und geben diese Signale an das Innere der Zelle weiter, die dann darauf reagiert. CXCR4 unterstützt im Normalfall das menschliche Immunsystem. Allerdings spielt es auch bei der Metastasenbildung und beim Eindringen von HI-Viren in das Zellinnere eine wichtige Rolle.
Es gibt Hinweise darauf, dass einige GPCRs Paare bilden müssen, sogenannte Dimere, um äußere Reize aufzunehmen und weiterzuleiten. Die Simulationen der FAU-Wissenschaftler zeigten nun, dass Cholesterin die Paarbildung von CXCR4 und damit vermutlich deren Funktion stark beeinflusst. Das heißt: Cholesterin ist erforderlich, damit diese sich passend zusammenlagern.
Cholesterinmoleküle „kleben“ dabei selektiv spezifische Regionen zweier CXCR4-Proteine aneinander, so dass eine komplexe Struktur entsteht, die vermutlich Signale wahrnehmen und durch die Zellmembran weiterleiten kann. Zwar können sich die Rezeptoren auch ohne genügend Cholesterin aneinander binden, jedoch bilden sich dabei unterschiedliche Strukturen, die wahrscheinlich die Signalweiterleitung an das Zellinnere unterdrücken.
Bisher waren diese Prozesse auf molekularer Ebene nicht vollständig erforscht. Die beiden Wissenschaftler der Arbeitsgruppe Computational Biology am Lehrstuhl für Biotechnik der FAU haben mit über 1000 einzelnen Computersimulationen diese Vorgänge studiert. Ein besseres Verständnis der Rolle von Cholesterin und der Dimerbildung in der Funktion von GPCRS könnte neue Wege für die Entwicklung von Medikamenten öffnen.
*Doi: http://dx.plos.org/10.1371/journal.pcbi.1005169
Weitere Informationen:
Prof. Dr. Rainer Böckmann
Tel.: 09131/85-25409
rainer.boeckmann@fau.de