Carbin – eine außergewöhnliche Form des Kohlenstoffs
Internationales Forschungsteam untersucht optische Bandlücke der Kohlenstoffverbindung
Welche photophysikalischen Eigenschaften hat Carbin? Das haben Wissenschaftlerinnen und Wissenschaftler der FAU, der kanadischen University of Alberta und der schweizerischen Ecole Polytechnique Fédérale de Lausanne gemeinsam untersucht – und ein tiefergreifendes Verständnis für diese außergewöhnliche Form des Kohlenstoffs entwickelt. Die Ergebnisse wurden in der jüngsten Ausgabe der renommierten Fachzeitschrift Nature Communications vorgestellt.
„Kohlenstoff nimmt eine absolute Sonderstellung im Periodensystem der Elemente ein und bildet mit seiner extrem großen Zahl an chemischen Verbindungen die Grundlage allen Lebens“, sagt Prof. Dr. Dirk M. Guldi vom Lehrstuhl für Physikalische Chemie I der FAU. „Die bekanntesten Beispiele sind dreidimensionaler Graphit und Diamant. Aber auch zweidimensionales Graphen, eindimensionale Nanoröhren und nulldimensionale Nanodots eröffnen neue Möglichkeiten für elektronische Anwendungen der Zukunft.“
Material mit außergewöhnlichen Eigenschaften
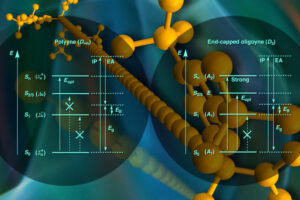
Carbin ist eine Modifikation des Kohlenstoffs, ein sogenanntes Allotrop. Es wird synthetisch hergestellt, besteht aus einer einzigen sehr langen Kette von Kohlenstoffatomen und gilt als Material mit äußerst interessanten elektronischen und mechanischen Eigenschaften. „Doch Kohlenstoff zeigt in dieser Form eine hohe Reaktivität“, betont Prof. Dr. Clémence Corminboeuf von der EPFL. „So lange Ketten sind äußerst instabil und entsprechend schwierig zu charakterisieren.“
Dem internationalen Forschungsteam ist diese Charakterisierung über Umwege dennoch gelungen. Die Wissenschaftlerinnen und Wissenschaftler um Prof. Dr. Dirk M. Guldi von der FAU, Prof. Dr. Clémence Corminboeuf und Prof. Dr. Holger Frauenrath von der EPFL sowie Prof. Dr. Rik R. Tykwinski von der University of Alberta haben bisherige Annahmen hinsichtlich der photophysikalischen Eigenschaften von Carbin hinterfragt und neue Erkenntnisse gewonnen.
Das Forschungsteam stützte sich dabei vor allem auf sogenannte Oligoine: „Wir können Carbin-Ketten in definierter Länge herstellen und vor Zersetzung schützten, indem wir an den Kettenenden eine Art Stoßstange aus Atomen einbauen. Diese chemisch ausreichend stabile Verbindungklasse wird Oligoine genannt“, erklärt Prof. Dr. Holger Frauenrath von der EPFL.
Optische Bandlücke nutzen
Die Wissenschaftlerinnen und Wissenschaftler haben gezielt zwei Serien von Oligoinen hergestellt – mit unterschiedlicher Symmetrie und mit bis zu 24 alternierenden Dreifach- und Einfachbindungen. Im Anschluss daran verfolgten sie mittels Spektroskopie die Deaktivierungsprozesse der jeweiligen Moleküle von der Anregung durch Licht bis hin zur vollständigen Relaxation. „So konnten wir den gesamten Deaktivierungsweg der Oligoine aus einem angeregten Zustand zurück in den ursprünglichen Grundzustand mechanistisch erfassen – und dank der gewonnen Daten eine Vorhersage über die Eigenschaften von Carbin treffen“, bilanziert Prof. Dr. Rik R. Tykwinski von der University of Alberta.
Eine wichtige Erkenntnis dabei: Die sogenannte optische Bandlücke erwies sich als deutlich kleiner als bisher angenommen. Die Bandlücke ist ein Begriff aus der Halbleiterphysik und beschreibt die elektrische Leitfähigkeit von Kristallen, Metallen und Halbleitern. „Das ist ein Riesenvorteil“, sagt Prof. Guldi, „Je kleiner die Bandlücke ist, desto weniger Energie muss zugeführt werden, um Strom zu leiten.“ Diese wichtige Eigenschaft besitzt zum Beispiel Silizium, das aktuell in Mikrochips ebenso steckt wie in Solarzellen. Carbin könnte – dank seiner ausgezeichneten photophysikalischen Eigenschaften – eines Tages Silizium ergänzen.
Weitere Informationen
DOI: 10.1038/s41467-020-18496-4
Prof. Dr. Dirk M. Guldi
Lehrstuhl für Physikalische Chemie I
Friedrich-Alexander-Universität Erlangen-Nürnberg
E-Mail: dirk.guldi@fau.de
