Direkt in der Nase: Antimikrobielles Peptid bekämpft krankmachende Bakterien
Forschungsteam mit Beteiligung der FAU Erlangen entschlüsselt molekulare Funktionsweise
Sind wir als Menschen im Alltag unterwegs, so begleiten sie uns stetig und sind für die Erhaltung unserer Gesundheit von großer Bedeutung – Milliarden von Mikroorganismen. Diese bilden eine Gemeinschaft auf unseren Körperoberflächen, welches als humanes Mikrobiom bezeichnet wird, individuell wie ein Fingerabdruck gehören sie zu jedem Menschen. Als erwachsener Mensch sind wir Träger von mehr Bakterienzellen als körpereigenen Zellen, die Bakterien siedeln mit ihrem genetischen Material und ihrem eigenen Stoffwechsel auf uns. Für die Gesundheit unseres Darms, Mundraumes, und sogar des Immunsystems, aber auch Augen oder Haut ist die Zusammensetzung der verschiedenen Bakterien-Lebensgemeinschaften und deren Stoffwechselprodukte ganz entscheidend.
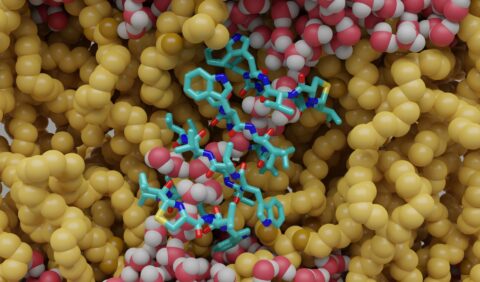
Eines dieser Produkte ist Lugdunin, ein zyklisches Peptid, das 2016 aus einem Bakterium der menschlichen Nase entdeckt wurde und in Studien der Universität Tübingen vielversprechende Wirksamkeit gegen Staphylokokken-Keime und für die Funktion des Immunsystems gezeigt hat. Forschende der Universitäten Göttingen, Erlangen-Nürnberg und Tübingen haben nun erstmals die Funktionsweise des Moleküls entschlüsselt: Durch Wechselwirkungen zwischen Lugdunin-Molekülen bildet es in Zellmembranen nanometergroße Kanäle, die Ionen transportieren können. Dieser Eingriff in die normalerweise ausbalancierten Konzentrationsverhältnisse einer bakteriellen Zelle tötet diese letztendlich ab. Die neuen Erkenntnisse legen die Grundlage für die Anwendung von Lugdunin beispielsweise auf Oberflächen und wurden in der Fachzeitschrift Nature Communications veröffentlicht.
Die genaue Wirkungsweise von kleinen Molekülen in Zellmembranen zu erforschen, ist sehr schwierig, da Membranen von Lebewesen hochkomplexe Systeme aus Millionen miteinander verbundener Bestandteile sind. Die Wissenschaftlerinnen und Wissenschaftler verwendeten daher vereinfachte Modelle dieser Membranen. Solche Modellmembranen bestehen nur aus den einfachsten Bauteilen, den sogenannten Lipiden, und ermöglichen so eine gezielte Untersuchung der Interaktion von Lugdunin mit Zellmembranen ohne andere störende Faktoren. Um das Lugdunin in ausreichend großen Mengen zu erhalten, stellten die Forschenden der Universität Tübingen es mittels chemischer Synthese her und führten dabei einige Veränderungen in die Struktur des Moleküls ein. Mit einer speziellen experimentellen Technik konnten Dominik Ruppelt und Claudia Steinem (Uni Göttingen) nach Zugabe von Lugdunin einen winzigen Ionenstrom über die Membran messen und damit belegen, dass Lugdunin auf diese Weise bakterielle Zellen bekämpft. Mittels Computersimulationen konnten Marius Trollmann und Rainer Böckmann (Computational Biology, FAU) mit Unterstützung des Zentrums für Nationales Hochleistungsrechnen Erlangen (NHR@FAU) schließlich aufzeigen, dass sich einzelne Lugdunin-Moleküle in einer Membran zusammenschließen und aufeinanderstapeln. Dadurch entsteht eine hohle, röhrenförmige Struktur mit einem Durchmesser von weniger als einem Nanometer. Diese durchspannt die Membran und ermöglicht den Transport von Wasser und insbesondere auch von Ionen (Video zur Bildung des Kanals, Video zum Transport von Wasser durch den Kanal).
Das Verständnis der Wirkungsweise von Lugdunin ist in der Diskussion um die richtige Zusammensetzung des Mikrobioms in gesunden Menschen von großem Interesse. Der vorgeschlagene Mechanismus der Bildung von Nanoröhren wurde bisher für kein anderes natürlich vorkommendes zyklisches Peptid beschrieben. „Die Ergebnisse bergen daher großes Potenzial für die Entwicklung von weiteren, neuen, das Mikrobiom regulierende Substanzen und insbesondere für die weitere Erforschung von Lugdunin als Mediator für unsere Gesundheit.“, so die Autoren der Studie.
Weitere Informationen
Originalveröffentlichung:
Ruppelt, D., Trollmann, …, Stephanie Grond, Rainer A. Böckmann* & Claudia Steinem*. The antimicrobial fibupeptide lugdunin forms water-filled channel structures in lipid membranes. Nat Commun15, 3521 (2024). https://doi.org/10.1038/s41467-024-47803-6
Kontakt:
Prof. Dr. Rainer Böckmann
Telefon: (09131) 85 -25409
E-Mail: rainer.boeckmann@fau.de
Prof. Dr. Claudia Steinem
Telefon: (0551) 39-23294
E-Mail: csteine@gwdg.de